CE Marking 의미
인증개요
CE마크는 해당 제품이 관련된 EC규정 또는 지침 및 유럽 표준규격의 필수요구사항을 준수한다는 것을 의미합니다. 의료기기의 경우 1998년 6월부터 CE마크 부착이 의무화 되었습니다. 유럽지역으로 수출되는 모든 의료기기는 CE 마크를 부착이 필요하기 때문에 유럽시장 진출을 위해서는 CE 마크 취득이 반드시 필요합니다. 이에 따라 본 컨설팅서비스는 해당 의료기기의 CE 의료기기 인증 획득을 목표로 하고 있습니다.
CE 인증 효과
인증절차
 MDR 의료기기 정의
MDD에서 MDR로 변경됨에 따라 의료기기의 정의도 대폭 확대 되었습니다.
MDR에서 의료기기란 인간을 위한 한가지 이상의 아래의 특수한 의료 목적으로 단독 또는 조합하여 사용하도록 제조자가 의도한 기기, 기구, 장치, 소프트웨어, 임플란트, 시약, 자재(재료) 혹은 기타 의료용 물품을 의미합니다.
MDR 의료기기 정의
MDD에서 MDR로 변경됨에 따라 의료기기의 정의도 대폭 확대 되었습니다.
MDR에서 의료기기란 인간을 위한 한가지 이상의 아래의 특수한 의료 목적으로 단독 또는 조합하여 사용하도록 제조자가 의도한 기기, 기구, 장치, 소프트웨어, 임플란트, 시약, 자재(재료) 혹은 기타 의료용 물품을 의미합니다.
MDR 등급분류
MDR에서는 MDD보다 등급분류 규칙을 보다 명확하게 하였습니다.
22개의 규칙을 통해 의료기기의 의도된 목적과 위험도를 4개의 등급으로 분류합니다.
MDD vs MDR (주요조항비교)
MDR 주요개정사항
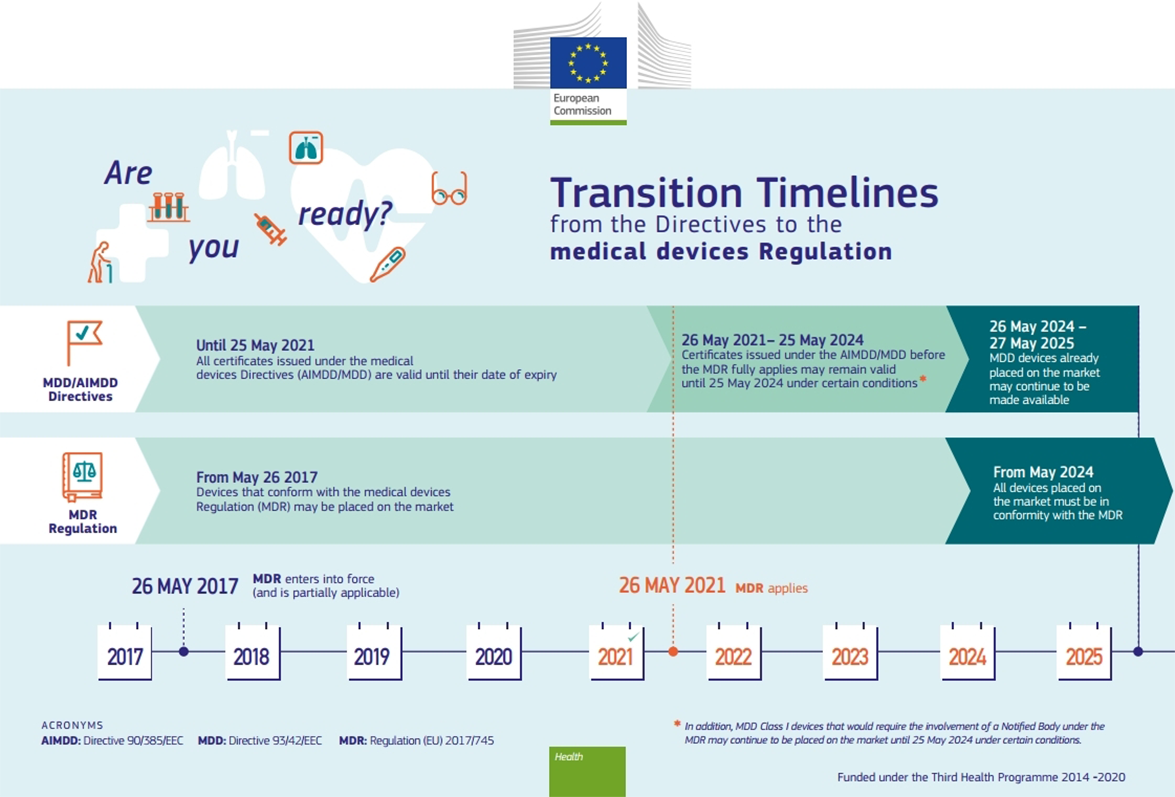
MDR Transition Timeline

|
- 제조자의 생산품이 관련 지침 및 제품규격의 의무사항에 적합 - CE 마크의 치수는 최소 5mm - 다른 마크와 혼용 및 오용을 금지해 쉽게 인식하게 하며 훼손방지책 마련 - 제조자, 인증기관, EU 현지대리인 부착 - Risk에 따른 적합성 평가절차에 따라 인증기관번호 삽입 |
- - 기본적인 안전조건(필수요구조건)을 충족시킴으로써 안전한 제품을 소비자에게 제공
- - 제품에 CE Mark를 부착함으로써 EU 연합내의 수출에 제한이 없음
- - 제품의 안전성을 확보를 통한 소송 위험성 경감
- - EU 연합내의 수출경쟁력 강화 (EU 요구사항 - EU 회원국내 모든 제품에 대해 CE Mark 의무화)
-
- 회사의 이미지 제고와 신뢰성 향상
No CE Mark = No sales in the European Community
| 의료기기 | Directive 93/42/EEC (MDD) (2021년 05월 이후 폐지) | Regulation 2017/745 (MDR) |
|---|---|---|
| Directive 90/385/EEC (AIMD) (2021년 05월 이후 폐지) | ||
| 체외진단 의료기기 | Directive 98/79/EC (IVD) (2022년 05월 이후 폐지) | Regulation 2017/745 (IVDR) |
| 개인보호장비 | Regulation 2016/425 (PPE) | |
 MDR 의료기기 정의
MDD에서 MDR로 변경됨에 따라 의료기기의 정의도 대폭 확대 되었습니다.
MDR에서 의료기기란 인간을 위한 한가지 이상의 아래의 특수한 의료 목적으로 단독 또는 조합하여 사용하도록 제조자가 의도한 기기, 기구, 장치, 소프트웨어, 임플란트, 시약, 자재(재료) 혹은 기타 의료용 물품을 의미합니다.
MDR 의료기기 정의
MDD에서 MDR로 변경됨에 따라 의료기기의 정의도 대폭 확대 되었습니다.
MDR에서 의료기기란 인간을 위한 한가지 이상의 아래의 특수한 의료 목적으로 단독 또는 조합하여 사용하도록 제조자가 의도한 기기, 기구, 장치, 소프트웨어, 임플란트, 시약, 자재(재료) 혹은 기타 의료용 물품을 의미합니다.
- - 질병의 진단, 예방, 모니터링 예측, 예상, 치료 또는 경감
- - 부상/장애상태의 진단, 모니터링, 치료, 경감, 혹은 부상/장애를 위한 보정
- - 해부학 또는 생리학적 또는 병리학적 과정 또는 상태의 시험, 교체 또는 수정
- - 장기, 혈액 및 조직 기증을 포함한 인체 유래 샘플의 체외검사를 통해 정보 제공
- - 인체 내부 또는 표면에서 약리학적, 면역학적 또는 신진대사적 방법에 의해 주요 의도된 작용을 달성하지 못하지만, 그런 방법에 의해 기능을 보조할 수 있는 장치
- - 임신 관리 또는 임신 지원용 기기
- - 의료기기의 세척, 소독 또는 멸균을 위해 특별히 의도된 제품
- - Annex XVI: Article 1(2)에 언급된 비의료용 제품군 리스트
| 1 | 콘택트렌즈 또는 비처방 렌즈와 같이 눈 위 또는 안에 들어가도록 의도된 기타 물품 |
|---|---|
| 2 | 신체 부위의 해부학적 구조를 변형 또는 고정을 하고자 하는 목적으로 외과적인 수단을 통해 신체에 완전히 또는 부분적으로 사용되는 제품 (타투나 피어싱을 위한 제품은 제외) |
| 3 | 피하, 점막 밑 또는 피부 내 주사 또는 다른 시술로 안면 또는 다른 피부나 점막을 채우는데 사용되는 물질, 물질의 혼합물 또는 물품 (타투를 위한 제품은 제외) |
| 4 | 지방 흡입, 지방 분해 또는 지방 성형술 장비와 같이 지방 조직을 감소소, 제거, 또는 파괴하기 위해 사용되는 장비 |
| 5 | 피부 재생, 타투 또는 제모, 또는 기타 피부치료를 위해 사용되는 레이저 및 강한 펄스 광선 장비와 같은 간섭성 및 비간섭성 광원, 단색광 및 장파선 자외선을 포함하는 인체에 사용하기 위한 고강도 전자 방사선 방출 장비 |
| 6 | 뇌의 신경활동을 변형하기 위해 두개골을 관통하는 전류나 자기장, 전자기장을 적용하는 뇌 자극용 장비 |
| MDD | MDR | |
|---|---|---|
| 비침습기기 (Non-invasive Device) | Rule 1~4 | Rule 1~4 |
| 침습기기 (Invasive Device) | Rule 5~8 | Rule 5~8 |
| 능동형기기 (Active Device) | Rule 9~12 | Rule 9~13 |
| 특별규칙 (Special Rules) | Rule 13~18 | Rule 14~22 |
|
MDD (Medical Device Directive) D=Directive : Legislation that sets out rules and must be transposed into national law to be effective |
MDR (Medical Device Regulation) R=Regulation : Mandatory Jurisdiction that is directly applicable and enforceable in all EU Member States. |
|---|---|
|
1. Medical Device Directive(Article 1) 의료기기의 정의 |
1. Medical Device Regulation(Article 2) 의료기기 정의 |
|
2. Device Class(Article 9, Annex Ⅸ) 의료기기 등급분류 |
2. Device Class(Article 41, Annex Ⅶ) 의료기기 등급분류 |
|
3. Conformity Assessment Procedure(Article 11) 적합성 평가 절차 |
3. Conformity Assessment Procedure(Article 42, Annex Ⅷ, Ⅸ, Ⅹ, XI) 적합성 평가 절차 |
|
4. Essential Requirements(Article 3, Annex Ⅰ) 필수 요구사항 |
4. Safety & Performance Requirements(Article 4, Annex Ⅰ) 안전&성능 요구사항 |
|
5. Technical Documentation(Annex Ⅱ, Ⅲ, Ⅶ) 기술문서 요건 |
5. Technical Documentation(Annex Ⅱ) 기술문서 요건 |
|
6. Declaration of Conformity(Annex Ⅱ~Ⅶ) DoC 자가적합선언 |
6. Declaration of Conformity(Article 17, Annex Ⅲ) DoC 자가적합선언 |
|
7. CE Mark(AnnexXII) CE 마크 부착요령 |
7. CE Mark(Article 18, Annex Ⅳ) CE마크 부착요령 |
| 주요사항 | 세부내용 |
|---|---|
| 기술 문서 강화 | Annex Ⅱ의 기술문서 부분이 세분화 됨은 물론, 지속적인 업데이트가 요구됨 |
| 식별, 추적성 향상 | 모든 의료기기 제품은 고유식별코드(Unique Device identification, UDI)가 적용되어야 함 |
| 라벨링 | 새로운 제품 라벨링 규제 적용 |
| 유럽 의료기기 데이터베이스 (EUDAMED) |
유럽 의료기기 데이터베이스(EUDAMED) 확장으로 등록 준비가 요구됨. 현재까지 이 데이터베이스는 국가 기관에서만 접근 가능했으나 제조사, 인증기관, 일반 대중에 공개될 예정 |
| 새로운 시험과정 도입 | 고위험 의료기기에 대한 심사를 위한 전문가 자문기구(Medical Device Coordination Group, MDCG)에 새로운 지원서류가 요구될 수 있음 |
| 의료기기 등급 변경 | Class ⅡB 군의 생체이식 시리즈 기기들은 ClassⅢ의 규정을 만족해야만하며, 대부분의 소프트웨어 CLASSⅠ로 편입될 가능성이 낮음 |
| 위험물질 함유기기 | 발암 물질, 기형 발생 유발 물질, 생식장애 물질함유 기기에 대한 규정 강화 |
| 재사용 규제 | 사용하고 난 일회용품의 원료, 부품의 재사용에 대한 규제 강화 |
| 임상시험 | 임상연구 및 임상시험에 대한 새로운 규정이 마련될 예정이며, 임상 평가의 업데이트를 위해 중요한 시판 후 감시 데이터가 이용돼야 함 |
| 품질관리 | 제조사는 기업 내에서 자격을 갖춘 품질관리사를 지정해 의료기기 제품에 대한 전문적인 지식을 보유하고 있어야 함 |
| 인증기관 강화 | 유럽 차원에서 합의된 인증기관에 대한 새로운 시험 증명이 마련될 예정으로, 인증 기관의 재검증이 이뤄지는바 인증기관 취소에 따른 인증취소 대비가 요구됨. 또한 고위험 의료기기 승인을 위한 특별 인증기관이 마련될 예정 |




 HOME
HOME